Questão 15
As propriedades do íon fluoreto como agente de prevenção de cáries foram reconhecidas primordialmente na década de 1930, quando pesquisadores observaram que existia uma forte correlação entre a concentração do íon fluoreto na água de abastecimento, a cárie dental e a fluorose endêmica – doença causada por consumo excessivo de flúor. Assim, os dentifrícios contêm como fonte de fluoreto basicamente fluoreto de sódio, monofluorfosfato de sódio (MFP) ou combinações entre esses ingredientes, em concentrações que variam de 1000 a 1500 mg de fluoreto por quilograma de produto final. É recomendado como limite máximo de ingestão de fluoreto 0,07 mg/kg de peso/dia para crianças com dentes durante o desenvolvimento pré-eruptivo, independentemente da fonte de ingestão. Já para água de abastecimento tratada, o valor limite, pela legislação brasileira vigente, é de 1,5 mg/L. A equação abaixo representa a reação entre MFP e água:
Na2PO3F(aq) + H2O(l)
NaH2PO4(aq) + NaF(aq)
Com base nas informações e na equação, analise as proposições.
I. Considerando o creme dental como a única fonte de ingestão de fluoreto e que crianças, em geral, ingerem todo creme dental que usam, uma criança com 14 kg não deveria usar diariamente mais que 1 g de creme dental contendo 7,58 mg de MFP/g de produto final.
II. Tendo como fonte de ingestão tanto a água de abastecimento incorretamente fluoretada em uma concentração de 0,4 mg/L como um creme dental com 1500 mg de fluoreto por kg, uma criança com 12 kg de peso, que toma 600 mL de água por dia, não deveria usar, nesse mesmo dia, uma massa desse creme dental superior a 0,4 g.
III. A equação representa a reação de hidrólise do MFP, gerando o dihidrogenofosfato de sódio e fluoreto de sódio, podendo ser classificada como uma reação ácido-base, na qual o MFP é o ácido e a água é a base.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I e III são verdadeiras.
B. ( ) Somente a afirmativa III é verdadeira.
C. ( ) Somente as afirmativas II e III são verdadeiras.
D. ( ) Somente a afirmativa II é verdadeira.
E. ( ) Todas as afirmativas são verdadeiras.
OBSERVAR A FÓRMULA DO FOSFITO DE SÓDIO E FOSFATO DIÁCIDO DE SÓDIO E DA ÁGUA - ONDE O NÚMERO DE ATOMICIDADE DEVERIA VIR EM SUBSCRITO.
Questão 16
Cinética química é a parte da Química que estuda a velocidade das reações, a influência das concentrações de produtos e os reagentes na velocidade, assim como a influência de outros fatores, como temperatura, presença de catalisador, inibidor, etc. Em termodinâmica estuda-se o equilíbrio entre espécies químicas em uma reação, assim como fatores que influenciam o deslocamento desse equilíbrio, que podem ser variados de forma a maximizar ou minimizar a obtenção de um determinado composto.
Sobre essas duas importantes áreas da Química, analise as proposições.
I. A influência da concentração dos reagentes sobre a velocidade de uma reação é dada pela sua lei de velocidade, que é uma expressão matemática que sempre envolve a concentração de todos os reagentes, cada um elevado ao seu coeficiente estequiométrico.
II. A posição de um dado equilíbrio químico – o lado para o qual ele se encontra majoritariamente deslocado – pode ser deduzida a partir da lei de velocidade para qualquer equilíbrio químico.
III. Reações lentas são reações necessariamente deslocadas para os reagentes. Já reações rápidas se processam com consumo total dos reagentes e de maneira quase imediata.
IV. À pressão constante, o aumento da temperatura tem sempre uma influência de aumentar a velocidade de uma reação, mas o efeito desse aumento sobre o deslocamento do equilíbrio depende, primordialmente, da variação de entalpia para a reação na faixa de temperatura avaliada.
V. Tempo de meia vida é o tempo necessário para que a concentração de um reagente caia a metade de seu valor inicial, correspondendo ao tempo de equilíbrio da reação, que é definido como o tempo necessário para que metade dos produtos se transforme em reagente.
Assinale a alternativa correta.
A. ( ) Somente a afirmativa III é verdadeira.
B. ( ) Somente a afirmativa IV é verdadeira.
C. ( ) Somente as afirmativas I e V são verdadeiras.
D. ( ) Somente as afirmativas I, II e IV são verdadeiras.
E. ( ) Somente as afirmativas I, III e V são verdadeiras.
Para resolução das questões 17 e 18, considere as informações abaixo.
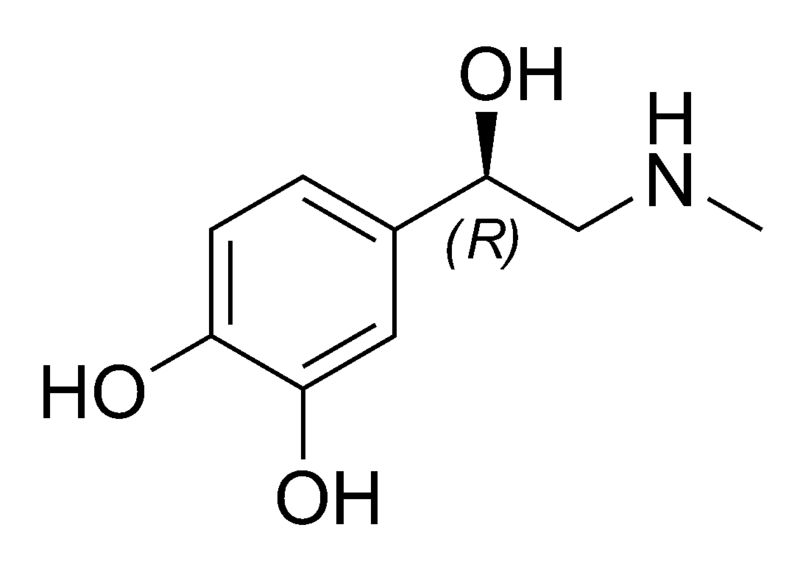
A molécula de epinefrina foi primeiramente isolada em sua forma pura em 1897 e sua estrutura
foi determinada em 1901. Ela é produzida na glândula adrenal (daí vem o seu nome usual,
adrenalina) como um único enantiômero.
Epinefrina
Questão 17
Analise as proposições em relação à molécula de epinefrina.
I. Possui seis carbonos com a configuração sp e três com configuração sp3.
II. A fórmula molecular é C9H13NO3.
III. Apresenta somente um carbono assimétrico.
IV. Apresenta as funções amida, álcool e fenol.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II e III são verdadeiras.
B. ( ) Somente a afirmativa II é verdadeira.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente as afirmativas I e II são verdadeiras.
E. ( ) Somente as afirmativas I e III são verdadeiras.
Questão 18
Analisando a estrutura da molécula de epinefrina, é incorreto afirmar que:
A. ( ) o átomo de nitrogênio está ligado a dois carbonos de configuração sp3.
B. ( ) apresenta ligações covalentes polares e apolares, em sua estrutura.
C. ( ) os três átomos de oxigênio estão ligados a carbonos e hidrogênios por meio de
ligações covalentes polares.
D. ( ) possui 17 ligações sigma (σ) e três ligações pi (π).
E. ( ) suas moléculas podem formar ligações de hidrogênio entre si.
Questão 19
Para limpeza de superfícies como concreto, tijolo, dentre outras, geralmente é utilizado um produto com nome comercial de “ácido muriático”. A substância ativa desse produto é o ácido clorídrico (HCl), um ácido inorgânico forte, corrosivo e tóxico. O volume de HCl em mililitros, que deve ser utilizado para preparar 50,0 mL de HCl 3 mol/L, a partir da solução concentrada com densidade de 1,18 g/cm3 e 37% (m/m) é, aproximadamente:
A. ( ) 150 mL
B. ( ) 12,5 mL
C. ( ) 125 mL
D. ( ) 8,7 mL
E. ( ) 87 mL
Questão 20
A ideia de equilíbrio químico foi proposta pela primeira vez pelo químico francês Claude Louis Berthollet em seu livro Essai de Estatique Chimique, em 1803. Basicamente, diz-se que uma reação química está em equilíbrio quando a proporção entre reagentes e produtos se mantém constante ao longo do tempo.
Considerando o conceito de equilíbrio químico, assinale a alternativa correta.
A. ( ) Para a reação em equilíbrio 2 SO2(g) + O2(g)
2 SO3(g) a 1000K, o valor da constante de equilíbrio é 0,215 quando PSO2 = 0,660 atm, PO2 = 0,390 atm e PSO3 = 0,0840 atm.
B. ( ) No equilíbrio químico entre íons cromato e dicromato em meio aquoso, 2 CrO42-(aq) + 2 H+(aq)
Cr2O72-(aq) + H2O(l), a adição de hidróxido de sódio irá privilegiar a formação de íons dicromato em solução.
C. ( ) Considerando a equação química que descreve o processo industrial para a síntese de amônia (processo Haber-Bosch): N2(g) + 3H2(g)
2 NH3(g), é possível afirmar que uma vez aumentada a pressão do sistema pela injeção de um gás inerte ou compressão do sistema, o equilíbrio químico é deslocado no sentido de formação dos produtos.
D. ( ) Os valores de Ka em meio aquoso para os ácidos cloroso e nitroso são 1,0×10-2 e 4,3×10-4, respectivamente. Com base nestes dados é possível afirmar que o pH de uma solução de HClO2 será maior que o de uma solução de HNO2, considerando soluções com concentrações idênticas.
E. ( ) A adição de um catalisador a um sistema em equilíbrio altera o valor numérico de sua constante, pois reduz sua energia de ativação.
Questão 21
Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale a alternativa correta.
A. ( ) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
B. ( ) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
C. ( ) No modelo atômico de Dalton, o átomo era tido como indivisível. O modelo sucessor foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado negativamente e uma eletrosfera.
D. ( ) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
E. ( ) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
Questão 22
Forças intermoleculares são responsáveis pela existência de diferentes fases da matéria, em que fase é uma porção da matéria que é uniforme, tanto em sua composição química quanto em seu estado físico. Com base nestas informações, relacione os termos às afirmações que melhor os descrevem.
(1) Ligações de hidrogênio
( )
Podem ocorrer quando sólidos tais com KCl ou NaI, por exemplo, interagem com moléculas como a água.
(2) Interações íon-dipolo
( )
Podem ocorrer quando elementos com eletronegatividade elevada estão ligados covalentemente com o átomo de hidrogênio.
(3) Forças de London
( )
São forças que estão presentes quando temos, por exemplo, uma amostra de acetona (propanona) dissolvida em etanoato de etila.
(4) Interações dipolo-dipolo
( )
Ocorrem entre compostos não polares, sendo esta um interação bastante fraca.
Assinale a alternativa que contém a sequência correta, de cima para baixo.
A. ( ) 2 – 4 – 3 – 1
B. ( ) 4 – 3 – 2 – 1
C. ( ) 2 – 1 – 4 – 3
D. ( ) 4 – 2 – 3 – 1
E. ( ) 3 – 1 – 4 – 2
Questão 23
Um dos problemas ambientais enfrentado em várias regiões do mundo é a chuva ácida. Esse fenômeno refere-se a uma precipitação mais ácida que a chuva natural, a qual possui um pH de aproximadamente 5,6, ou seja, chuva não poluída. A precipitação ácida causa a deterioração de estátuas feitas de rochas calcárias e de mármore, assim como a acidificação de lagos, levando à morte muitos organismos vivos, que não sobrevivem em meio ácido.
Analise as proposições sobre os processos envolvidos na chuva ácida.
I. A queima de combustíveis fósseis é um fator que contribui para o aumento da emissão de dióxido de enxofre e, consequentemente, a ocorrência de precipitações de caráter ácido.
II. Os dois ácidos predominantes na chuva ácida, responsáveis por conferir um caráter mais ácido, são os ácidos nítrico e sulfúrico. A formação do ácido sulfúrico pode ocorrer pela oxidação do dióxido de enxofre na atmosfera, resultando em trióxido de enxofre. Então, o gás trióxido de enxofre reage com a água e resulta na formação do ácido sulfúrico.
III. Em uma atmosfera limpa, ou seja, com níveis normais de dióxido de carbono, o pH da chuva é aproximadamente 5,6, devido à solubilização desse gás atmosférico na água, levando à formação do ácido carbônico.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II e III são verdadeiras.
B. ( ) Somente as afirmativas I e II são verdadeiras.
C. ( ) Somente as afirmativas I e III são verdadeiras.
D. ( ) Somente a afirmativa III é verdadeira.
E. ( ) Todas as afirmativas são verdadeiras.
Questão 24
Em relação aos estados físicos da matéria, analise as proposições.
I. Uma garrafa de vidro cheia de água foi colocada em um refrigerador a 4oC. Após algumas horas, a garrafa de vidro foi retirada do refrigerador e colocada em um ambiente a 25oC. Depois de alguns minutos, foi observada a formação de gotículas de água do lado de fora da garrafa. Esse fenômeno pode ser explicado devido ao fato de moléculas de vapor de água, presentes no ar, passarem pelo processo de liquefação ao entrarem em contato com a parede externa da garrafa de vidro.
II. Uma garrafa de vidro cheia de água foi colocada em um refrigerador a 4oC. Após algumas horas, a garrafa de vidro foi retirada do refrigerador e colocada em um ambiente a 25oC. Depois de alguns minutos, foi observada a formação de gotículas de água do lado de fora da garrafa. Esse fenômeno pode ser explicado devido ao fato das moléculas de água, no estado líquido, permearem o vidro, e ao encontrarem um ambiente com temperatura superior, sofrerem o processo de vaporização.
III. O estado físico de uma substância pode ser classificado em critérios de volume e forma. Sendo assim, o sal e a areia são classificados como líquidos, pois podem adquirir a forma de um recipiente.
Assinale a alternativa correta.
A. ( ) Somente a afirmativa III é verdadeira.
B. ( ) Somente as afirmativas I e II são verdadeiras.
C. ( ) Somente as afirmativas I e III são verdadeiras.
D. ( ) Somente a afirmativa I é verdadeira.
E. ( ) Todas as afirmativas são verdadeiras.
Questão 25
O bafômetro é um aparelho utilizado para medir a quantidade de álcool etílico na corrente sanguínea de uma pessoa. A quantidade de álcool no ar expirado por uma pessoa é proporcional à quantidade na corrente sanguínea. A reação de oxidação-redução (não balanceada) que ocorre é:
K2Cr2O7(aq) + H2SO4(aq) + H3CH2OH(g) Cr2(SO4)3(aq) + H2O(l) + CH3CHO(g) + K2SO4(aq)
Considerando a reação acima, assinale a alternativa correta.
A. ( ) O ácido sulfúrico é o agente oxidante e a semirreação de oxidação ocorre no anodo. A relação estequiométrica é de 1 mol de ácido sulfúrico para 1 mol de ácido acético.
B. ( ) A transferência de elétrons ocorre entre o ácido sulfúrico e o álcool etílico, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de +4 para +2.
C. ( ) O dicromato de potássio é o agente oxidante, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de -2 para -1; nessa reação a relação estequiométrica, 1 mol de dicromato de potássio resulta em 3 mols de ácido acético.
D. ( ) O dicromato de potássio é o agente oxidante, sendo que o número de oxidação -2 do carbono ligado ao grupamento OH no etanol passa para -1 no carbono do grupamento aldeído no etanal.
E. ( ) O dicromato de potássio é o agente redutor, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de -2 para -1; nessa reação a relação estequiométrica é de 3 mols de dicromato de potássio para 1 mol de ácido acético.
Questão 26
O planeta B possui sua própria tabela periódica, sendo que uma parte dela está representada na Figura 1. As propriedades periódicas no planeta B seguem as mesmas tendências observadas na Terra.
X T
Z A D
Com base nas informações acima, analise as proposições.
I. O elemento Z possui raio atômico maior que Q.
II. A ordem de eletronegatividade no segundo período é Z
III. O elemento L possui uma eletronegatividade maior que T.
IV. O maior raio atômico, nessa parte da tabela periódica, é o de Q.
V. O elemento X é menos eletronegativo que T.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II, IV e V são verdadeiras.
B. ( ) Somente as afirmativas I, II e V são verdadeiras.
C. ( ) Somente as afirmativas I, II, III e V são verdadeiras.
D. ( ) Somente as afirmativas IV e V são verdadeiras.
E. ( ) Somente a afirmativa IV é verdadeira.
Questão 27
As informações nutricionais de um produto alimentício constam no rótulo, mas, muitas vezes, são negligenciadas pelos consumidores. Entretanto, com o aumento nas taxas de obesidade e sobrepeso, além de outras doenças como diabetes e hipertensão, cada vez mais um número maior de consumidores passa a procurar as informações sobre a composição dos produtos que leva para casa.
Com base no exposto, analise as proposições.
I. Um produto alimentício possui a seguinte composição em massa: 40% carboidratos, 30% proteínas e 30% gorduras. Considerando que a queima de 1 g de proteínas ou carboidratos fornece 4 kcal e 1 g de gordura fornece 9 kcal, uma amostra de 75 g do produto possui um valor calórico de 550 kcal.
II. Um adulto que possua a recomendação de ingestão calórica diária de 2000 kcal, se esta pessoa ingerir 400 g do produto alimentício citado na afirmação (I) ela consumiu mais calorias que o recomendado.
III. A densidade energética é a quantidade de energia por grama. Se se considerar que todo o carboidrato da amostra seja glicose (C6H12O6 ΔH°c = -2808 kJ/mol) e toda a gordura seja ácido oleico (C18H34O2 ΔH°c = -10487 kJ/mol), pode-se afirmar que a gordura possui uma densidade energética maior do que o carboidrato.
IV. A entalpia de formação da glicose (C6H12O6) é -1268 kJ/mol. Dados: ΔH°f (CO2) = -393,51 kJ/mol, ΔH°f (H2O) = -285,83 kJ/mol e a entalpia de combustão da glicose ΔH°c = -2808 kJ/ mol.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I, II e III são verdadeiras.
B. ( ) Somente as afirmativas II, III e IV são verdadeiras.
C. ( ) Somente as afirmativas II e IV são verdadeiras.
D. ( ) Somente as afirmativas II e III são verdadeiras.
E. ( ) Somente as afirmativas I e IV são verdadeiras.
Questão 28
As características físico-químicas, que dependem somente da quantidade de partículas presentes em solução e não da natureza destas partículas, são conhecidas como propriedades coligativas.
Sobre as propriedades coligativas, analise as proposições.
I. A alface, quando colocada em uma vasilha contendo uma solução salina, murcha. Esse fenômeno pode ser explicado pela propriedade coligativa, chamada pressão osmótica, pois ocorre a migração de solvente da solução mais concentrada para a mais diluída.
II. Em países com temperaturas muito baixas ou muito elevadas, costuma-se adicionar etilenoglicol à água dos radiadores dos carros para evitar o congelamento e o superaquecimento da água. As propriedades coligativas envolvidas, nestes dois processos, são a crioscopia e a ebulioscopia, respectivamente.
III. Soluções fisiológicas devem possuir a mesma pressão osmótica que o sangue e as hemácias. Ao se utilizar água destilada no lugar de uma solução fisiológica ocorre um inchaço das hemácias e a morte delas. A morte das hemácias por desidratação também ocorre ao se empregar uma solução saturada de cloreto de sódio, Nas duas situações ocorre a migração do solvente (água) do meio menos concentrado para o meio mais concentrado.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I e II são verdadeiras.
B. ( ) Somente as afirmativas II e III são verdadeiras.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente a afirmativa II é verdadeira.
E. ( ) Somente as afirmativas I e III são verdadeiras.
Questão 28
As características físico-químicas, que dependem somente da quantidade de partículas presentes em solução e não da natureza destas partículas, são conhecidas como propriedades coligativas.
Sobre as propriedades coligativas, analise as proposições.
I. A alface, quando colocada em uma vasilha contendo uma solução salina, murcha. Esse fenômeno pode ser explicado pela propriedade coligativa, chamada pressão osmótica, pois ocorre a migração de solvente da solução mais concentrada para a mais diluída.
II. Em países com temperaturas muito baixas ou muito elevadas, costuma-se adicionar etilenoglicol à água dos radiadores dos carros para evitar o congelamento e o superaquecimento da água. As propriedades coligativas envolvidas, nestes dois processos, são a crioscopia e a ebulioscopia, respectivamente.
III. Soluções fisiológicas devem possuir a mesma pressão osmótica que o sangue e as hemácias. Ao se utilizar água destilada no lugar de uma solução fisiológica ocorre um inchaço das hemácias e a morte delas. A morte das hemácias por desidratação também ocorre ao se empregar uma solução saturada de cloreto de sódio, Nas duas situações ocorre a migração do solvente (água) do meio menos concentrado para o meio mais concentrado.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I e II são verdadeiras.
B. ( ) Somente as afirmativas II e III são verdadeiras.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente a afirmativa II é verdadeira.
E. ( ) Somente as afirmativas I e III são verdadeiras.
Questão 17
Analise as proposições em relação à molécula de epinefrina.
I. Possui seis carbonos com a configuração sp e três com configuração sp3.
II. A fórmula molecular é C9H13NO3.
III. Apresenta somente um carbono assimétrico.
IV. Apresenta as funções amida, álcool e fenol.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II e III são verdadeiras.
B. ( ) Somente a afirmativa II é verdadeira.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente as afirmativas I e II são verdadeiras.
E. ( ) Somente as afirmativas I e III são verdadeiras.
Questão 18
Analisando a estrutura da molécula de epinefrina, é incorreto afirmar que:
A. ( ) o átomo de nitrogênio está ligado a dois carbonos de configuração sp3.
B. ( ) apresenta ligações covalentes polares e apolares, em sua estrutura.
C. ( ) os três átomos de oxigênio estão ligados a carbonos e hidrogênios por meio de
ligações covalentes polares.
D. ( ) possui 17 ligações sigma (σ) e três ligações pi (π).
E. ( ) suas moléculas podem formar ligações de hidrogênio entre si.
Questão 19
Para limpeza de superfícies como concreto, tijolo, dentre outras, geralmente é utilizado um produto com nome comercial de “ácido muriático”. A substância ativa desse produto é o ácido clorídrico (HCl), um ácido inorgânico forte, corrosivo e tóxico. O volume de HCl em mililitros, que deve ser utilizado para preparar 50,0 mL de HCl 3 mol/L, a partir da solução concentrada com densidade de 1,18 g/cm3 e 37% (m/m) é, aproximadamente:
A. ( ) 150 mL
B. ( ) 12,5 mL
C. ( ) 125 mL
D. ( ) 8,7 mL
E. ( ) 87 mL
Questão 20
A ideia de equilíbrio químico foi proposta pela primeira vez pelo químico francês Claude Louis Berthollet em seu livro Essai de Estatique Chimique, em 1803. Basicamente, diz-se que uma reação química está em equilíbrio quando a proporção entre reagentes e produtos se mantém constante ao longo do tempo.
Considerando o conceito de equilíbrio químico, assinale a alternativa correta.
A. ( ) Para a reação em equilíbrio 2 SO2(g) + O2(g)
2 SO3(g) a 1000K, o valor da constante de equilíbrio é 0,215 quando PSO2 = 0,660 atm, PO2 = 0,390 atm e PSO3 = 0,0840 atm.
B. ( ) No equilíbrio químico entre íons cromato e dicromato em meio aquoso, 2 CrO42-(aq) + 2 H+(aq)
Cr2O72-(aq) + H2O(l), a adição de hidróxido de sódio irá privilegiar a formação de íons dicromato em solução.
C. ( ) Considerando a equação química que descreve o processo industrial para a síntese de amônia (processo Haber-Bosch): N2(g) + 3H2(g)
2 NH3(g), é possível afirmar que uma vez aumentada a pressão do sistema pela injeção de um gás inerte ou compressão do sistema, o equilíbrio químico é deslocado no sentido de formação dos produtos.
D. ( ) Os valores de Ka em meio aquoso para os ácidos cloroso e nitroso são 1,0×10-2 e 4,3×10-4, respectivamente. Com base nestes dados é possível afirmar que o pH de uma solução de HClO2 será maior que o de uma solução de HNO2, considerando soluções com concentrações idênticas.
E. ( ) A adição de um catalisador a um sistema em equilíbrio altera o valor numérico de sua constante, pois reduz sua energia de ativação.
OBSERVAR A FÓRMULAS DOS COMPOSTOS ACIMA - ONDE O NÚMERO DE ATOMICIDADE DEVERIA VIR EM SUBSCRITO.
Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale a alternativa correta.
A. ( ) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
B. ( ) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
C. ( ) No modelo atômico de Dalton, o átomo era tido como indivisível. O modelo sucessor foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado negativamente e uma eletrosfera.
D. ( ) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
E. ( ) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
Questão 22
Forças intermoleculares são responsáveis pela existência de diferentes fases da matéria, em que fase é uma porção da matéria que é uniforme, tanto em sua composição química quanto em seu estado físico. Com base nestas informações, relacione os termos às afirmações que melhor os descrevem.
(1) Ligações de hidrogênio
( )
Podem ocorrer quando sólidos tais com KCl ou NaI, por exemplo, interagem com moléculas como a água.
(2) Interações íon-dipolo
( )
Podem ocorrer quando elementos com eletronegatividade elevada estão ligados covalentemente com o átomo de hidrogênio.
(3) Forças de London
( )
São forças que estão presentes quando temos, por exemplo, uma amostra de acetona (propanona) dissolvida em etanoato de etila.
(4) Interações dipolo-dipolo
( )
Ocorrem entre compostos não polares, sendo esta um interação bastante fraca.
Assinale a alternativa que contém a sequência correta, de cima para baixo.
A. ( ) 2 – 4 – 3 – 1
B. ( ) 4 – 3 – 2 – 1
C. ( ) 2 – 1 – 4 – 3
D. ( ) 4 – 2 – 3 – 1
E. ( ) 3 – 1 – 4 – 2
Questão 23
Um dos problemas ambientais enfrentado em várias regiões do mundo é a chuva ácida. Esse fenômeno refere-se a uma precipitação mais ácida que a chuva natural, a qual possui um pH de aproximadamente 5,6, ou seja, chuva não poluída. A precipitação ácida causa a deterioração de estátuas feitas de rochas calcárias e de mármore, assim como a acidificação de lagos, levando à morte muitos organismos vivos, que não sobrevivem em meio ácido.
Analise as proposições sobre os processos envolvidos na chuva ácida.
I. A queima de combustíveis fósseis é um fator que contribui para o aumento da emissão de dióxido de enxofre e, consequentemente, a ocorrência de precipitações de caráter ácido.
II. Os dois ácidos predominantes na chuva ácida, responsáveis por conferir um caráter mais ácido, são os ácidos nítrico e sulfúrico. A formação do ácido sulfúrico pode ocorrer pela oxidação do dióxido de enxofre na atmosfera, resultando em trióxido de enxofre. Então, o gás trióxido de enxofre reage com a água e resulta na formação do ácido sulfúrico.
III. Em uma atmosfera limpa, ou seja, com níveis normais de dióxido de carbono, o pH da chuva é aproximadamente 5,6, devido à solubilização desse gás atmosférico na água, levando à formação do ácido carbônico.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II e III são verdadeiras.
B. ( ) Somente as afirmativas I e II são verdadeiras.
C. ( ) Somente as afirmativas I e III são verdadeiras.
D. ( ) Somente a afirmativa III é verdadeira.
E. ( ) Todas as afirmativas são verdadeiras.
Questão 24
Em relação aos estados físicos da matéria, analise as proposições.
I. Uma garrafa de vidro cheia de água foi colocada em um refrigerador a 4oC. Após algumas horas, a garrafa de vidro foi retirada do refrigerador e colocada em um ambiente a 25oC. Depois de alguns minutos, foi observada a formação de gotículas de água do lado de fora da garrafa. Esse fenômeno pode ser explicado devido ao fato de moléculas de vapor de água, presentes no ar, passarem pelo processo de liquefação ao entrarem em contato com a parede externa da garrafa de vidro.
II. Uma garrafa de vidro cheia de água foi colocada em um refrigerador a 4oC. Após algumas horas, a garrafa de vidro foi retirada do refrigerador e colocada em um ambiente a 25oC. Depois de alguns minutos, foi observada a formação de gotículas de água do lado de fora da garrafa. Esse fenômeno pode ser explicado devido ao fato das moléculas de água, no estado líquido, permearem o vidro, e ao encontrarem um ambiente com temperatura superior, sofrerem o processo de vaporização.
III. O estado físico de uma substância pode ser classificado em critérios de volume e forma. Sendo assim, o sal e a areia são classificados como líquidos, pois podem adquirir a forma de um recipiente.
Assinale a alternativa correta.
A. ( ) Somente a afirmativa III é verdadeira.
B. ( ) Somente as afirmativas I e II são verdadeiras.
C. ( ) Somente as afirmativas I e III são verdadeiras.
D. ( ) Somente a afirmativa I é verdadeira.
E. ( ) Todas as afirmativas são verdadeiras.
Questão 25
O bafômetro é um aparelho utilizado para medir a quantidade de álcool etílico na corrente sanguínea de uma pessoa. A quantidade de álcool no ar expirado por uma pessoa é proporcional à quantidade na corrente sanguínea. A reação de oxidação-redução (não balanceada) que ocorre é:
K2Cr2O7(aq) + H2SO4(aq) + H3CH2OH(g) Cr2(SO4)3(aq) + H2O(l) + CH3CHO(g) + K2SO4(aq)
Considerando a reação acima, assinale a alternativa correta.
A. ( ) O ácido sulfúrico é o agente oxidante e a semirreação de oxidação ocorre no anodo. A relação estequiométrica é de 1 mol de ácido sulfúrico para 1 mol de ácido acético.
B. ( ) A transferência de elétrons ocorre entre o ácido sulfúrico e o álcool etílico, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de +4 para +2.
C. ( ) O dicromato de potássio é o agente oxidante, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de -2 para -1; nessa reação a relação estequiométrica, 1 mol de dicromato de potássio resulta em 3 mols de ácido acético.
D. ( ) O dicromato de potássio é o agente oxidante, sendo que o número de oxidação -2 do carbono ligado ao grupamento OH no etanol passa para -1 no carbono do grupamento aldeído no etanal.
E. ( ) O dicromato de potássio é o agente redutor, sendo que o número de oxidação do carbono vizinho ao grupamento OH varia de -2 para -1; nessa reação a relação estequiométrica é de 3 mols de dicromato de potássio para 1 mol de ácido acético.
Questão 26
O planeta B possui sua própria tabela periódica, sendo que uma parte dela está representada na Figura 1. As propriedades periódicas no planeta B seguem as mesmas tendências observadas na Terra.
X T
Z A D
Q L
Figura 1
Com base nas informações acima, analise as proposições.
I. O elemento Z possui raio atômico maior que Q.
II. A ordem de eletronegatividade no segundo período é Z
III. O elemento L possui uma eletronegatividade maior que T.
IV. O maior raio atômico, nessa parte da tabela periódica, é o de Q.
V. O elemento X é menos eletronegativo que T.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas II, IV e V são verdadeiras.
B. ( ) Somente as afirmativas I, II e V são verdadeiras.
C. ( ) Somente as afirmativas I, II, III e V são verdadeiras.
D. ( ) Somente as afirmativas IV e V são verdadeiras.
E. ( ) Somente a afirmativa IV é verdadeira.
Questão 27
As informações nutricionais de um produto alimentício constam no rótulo, mas, muitas vezes, são negligenciadas pelos consumidores. Entretanto, com o aumento nas taxas de obesidade e sobrepeso, além de outras doenças como diabetes e hipertensão, cada vez mais um número maior de consumidores passa a procurar as informações sobre a composição dos produtos que leva para casa.
Com base no exposto, analise as proposições.
I. Um produto alimentício possui a seguinte composição em massa: 40% carboidratos, 30% proteínas e 30% gorduras. Considerando que a queima de 1 g de proteínas ou carboidratos fornece 4 kcal e 1 g de gordura fornece 9 kcal, uma amostra de 75 g do produto possui um valor calórico de 550 kcal.
II. Um adulto que possua a recomendação de ingestão calórica diária de 2000 kcal, se esta pessoa ingerir 400 g do produto alimentício citado na afirmação (I) ela consumiu mais calorias que o recomendado.
III. A densidade energética é a quantidade de energia por grama. Se se considerar que todo o carboidrato da amostra seja glicose (C6H12O6 ΔH°c = -2808 kJ/mol) e toda a gordura seja ácido oleico (C18H34O2 ΔH°c = -10487 kJ/mol), pode-se afirmar que a gordura possui uma densidade energética maior do que o carboidrato.
IV. A entalpia de formação da glicose (C6H12O6) é -1268 kJ/mol. Dados: ΔH°f (CO2) = -393,51 kJ/mol, ΔH°f (H2O) = -285,83 kJ/mol e a entalpia de combustão da glicose ΔH°c = -2808 kJ/ mol.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I, II e III são verdadeiras.
B. ( ) Somente as afirmativas II, III e IV são verdadeiras.
C. ( ) Somente as afirmativas II e IV são verdadeiras.
D. ( ) Somente as afirmativas II e III são verdadeiras.
E. ( ) Somente as afirmativas I e IV são verdadeiras.
Questão 28
As características físico-químicas, que dependem somente da quantidade de partículas presentes em solução e não da natureza destas partículas, são conhecidas como propriedades coligativas.
Sobre as propriedades coligativas, analise as proposições.
I. A alface, quando colocada em uma vasilha contendo uma solução salina, murcha. Esse fenômeno pode ser explicado pela propriedade coligativa, chamada pressão osmótica, pois ocorre a migração de solvente da solução mais concentrada para a mais diluída.
II. Em países com temperaturas muito baixas ou muito elevadas, costuma-se adicionar etilenoglicol à água dos radiadores dos carros para evitar o congelamento e o superaquecimento da água. As propriedades coligativas envolvidas, nestes dois processos, são a crioscopia e a ebulioscopia, respectivamente.
III. Soluções fisiológicas devem possuir a mesma pressão osmótica que o sangue e as hemácias. Ao se utilizar água destilada no lugar de uma solução fisiológica ocorre um inchaço das hemácias e a morte delas. A morte das hemácias por desidratação também ocorre ao se empregar uma solução saturada de cloreto de sódio, Nas duas situações ocorre a migração do solvente (água) do meio menos concentrado para o meio mais concentrado.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I e II são verdadeiras.
B. ( ) Somente as afirmativas II e III são verdadeiras.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente a afirmativa II é verdadeira.
E. ( ) Somente as afirmativas I e III são verdadeiras.
Questão 28
As características físico-químicas, que dependem somente da quantidade de partículas presentes em solução e não da natureza destas partículas, são conhecidas como propriedades coligativas.
Sobre as propriedades coligativas, analise as proposições.
I. A alface, quando colocada em uma vasilha contendo uma solução salina, murcha. Esse fenômeno pode ser explicado pela propriedade coligativa, chamada pressão osmótica, pois ocorre a migração de solvente da solução mais concentrada para a mais diluída.
II. Em países com temperaturas muito baixas ou muito elevadas, costuma-se adicionar etilenoglicol à água dos radiadores dos carros para evitar o congelamento e o superaquecimento da água. As propriedades coligativas envolvidas, nestes dois processos, são a crioscopia e a ebulioscopia, respectivamente.
III. Soluções fisiológicas devem possuir a mesma pressão osmótica que o sangue e as hemácias. Ao se utilizar água destilada no lugar de uma solução fisiológica ocorre um inchaço das hemácias e a morte delas. A morte das hemácias por desidratação também ocorre ao se empregar uma solução saturada de cloreto de sódio, Nas duas situações ocorre a migração do solvente (água) do meio menos concentrado para o meio mais concentrado.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I e II são verdadeiras.
B. ( ) Somente as afirmativas II e III são verdadeiras.
C. ( ) Somente a afirmativa III é verdadeira.
D. ( ) Somente a afirmativa II é verdadeira.
E. ( ) Somente as afirmativas I e III são verdadeiras.


Nenhum comentário:
Postar um comentário